背景:
异常代谢和生化过程导致的急性或慢性细胞应激可触发普遍的非凋亡形式的细胞死亡,通常称为铁死亡。铁死亡在不同的细胞死亡方式中是独特的,因为它主要与病理生理条件有关,因为一些代谢途径,如(硒)硫醇代谢、脂肪酸代谢、铁处理、甲戊酸途径和线粒体呼吸,直接影响细胞对脂质过氧化和铁死亡的敏感性。此外,关键的细胞氧化还原系统,如硒依赖性的谷胱甘肽过氧化物酶4和NAD(P)H/铁死亡抑制蛋白-1/泛素轴,正在持续监视和中和对细胞膜的氧化损伤。由于这种形式的细胞死亡出现作为多种疾病的根源,因为它提供了各种药物为治疗干预的靶点,在过去的几年里,人们对从分子上更好地了解铁死亡的死亡过程产生了极大的兴趣。
简介:
2020年12月1日,来自德国环境健康研究中心的Marcus Conrad教授课题组在Cell Metabolism(IF: 21.567)杂志上发表题为“The Metabolic Underpinnings of Ferroptosis”的综述[1]。

主要结果:
影响细胞对铁死亡易感性的代谢过程。
巯基依赖的氧化还原系统
含硫醇的三肽GSH是哺乳动物细胞中主要的抗氧化剂,也是GPX4的首选底物。导致谷胱甘肽衰竭的条件直接影响GPX4的活性和稳定性,从而使细胞更易发生铁死亡。谷胱甘肽的消耗也可以通过限制细胞内半胱氨酸来实现,半胱氨酸是谷胱甘肽生物合成的限速底物。内源性半胱氨酸主要是通过GSH-或硫氧还蛋白还原酶1 (TXNRD1)介导的胱氨酸还原而产生的,胱氨酸主要通过Xc-系统从细胞外空间输入。
细胞内半胱氨酸也至少在一定程度上可以通过透硫途径提供。在肝细胞中既缺乏Txnrd1又缺乏谷胱甘肽二硫还原酶(GSR)的基因工程小鼠,尽管在减少胱氨酸方面效率低下,却表现得出奇地好,因为通过反硫化的饮食蛋氨酸提供了半胱氨酸,而半胱氨酸是谷胱甘肽合成的基础。在erastin处理多日的卵巢癌细胞中,通过诱导转硫作用通路逐渐对胱氨酸缺乏产生应答,在一些肿瘤细胞中,转硫作用通路甚至不断被激活。
除谷胱甘肽外,硫氧还蛋白(TXN)是第二个关键的硫氧依赖抗氧化系统。在已建立的恶性肿瘤中,依赖于TXN的细胞浆系统经常被激活,同时抑制GSH和TXN通路是有效触发细胞死亡的既定途径。最近的一项研究表明,杀铁剂(一种TXN的抑制剂)确实会诱导癌细胞的铁死亡,这表明TXN系统至少在某些细胞环境中可能作为一种替代的铁死亡抑制因子。最后,值得一提的是,一氧化氮(NO)可能通过清除脂质自由基或自由基中间体,使M1型巨噬细胞和小胶质细胞对铁死亡产生抵抗。
甲戊酸途径是一种有价值的多用途代谢物来源
甲戊酸通路包括产生异戊烯基焦磷酸(IPP)、角鲨烯、CoQ10和胆固醇对铁死亡的几个层面的影响。IPP是角鲨烯和CoQ10的前体,也是Sec-tRNA酶异戊烯化的限制底物。用他汀类药物阻断甲戊酸途径的限速酶会降低GPX4的有效翻译,从而使细胞对铁死亡敏感。角鲨烯也被认为至少在一部分癌细胞中具有抗铁死亡活性。缺乏角鲨烯单加氧酶活性的细胞表现出角鲨烯积累和对铁死亡诱导物的抗性,当角鲨烯合成酶(SQS)被破坏时,这种抗性消失。胆固醇也被认为与铁死亡有关,因为它普遍存在于真核细胞的质膜中,并且对羟自由基等氧化剂具有内在的敏感性。
线粒体参与铁死亡
线粒体对铁死亡的作用仍有争议。一些研究小组主张线粒体在铁死亡中起着重要作用,而另一些人则认为线粒体或线粒体DNA缺失的细胞(r0细胞)仍然对铁死亡诱导物敏感。最近的一项研究提出线粒体对于erastin或胱氨酸饥饿诱导的铁死亡是必不可少的,而对于RSL3诱导的铁死亡则是必不可少的。这些结果在一定程度上与之前的研究结果一致,即线粒体减少的细胞对erastin表现出适度的抵抗,但对RSL3没有,尽管在较高的erastin浓度下细胞仍会死亡。线粒体促进铁死亡的作用可能归因于来自线粒体呼吸的活性氧(ROS),因为这些作用被线粒体电子转移复合物的抑制剂所破坏。
NADPH,预防铁死亡的主要推进剂
NADPH对于铁死亡至关重要,它不仅能滋养依赖谷胱甘肽和TXN的系统,还能促进甲戊酸的生物合成以及脂肪酸的重新合成和延伸。事实上,NADPH的基础水平被认为是多种癌细胞系铁死亡敏感性的生物标志物,而胞质NADPH磷酸酶(MESH1)消耗NADPH会促进铁死亡。然而,NADPH也是NADPH氧化酶(NOX)的底物,它故意产生超氧阴离子。NOX抑制剂已经被证明可以抑制人和植物细胞的铁死亡,而NOX4或NOX1的激活使细胞对铁死亡敏感。在肾细胞癌和卵巢癌细胞中,Hippo通路效应子TAZ也分别通过激活NOX4和NOX2促进铁死亡。
脂质过氧化-铁死亡的标志
PUFAs如何被氧化产生过氧化磷脂(PLOOH)并引发铁死亡是一个激烈的争论。换句话说,酶催化的脂质过氧化与非酶催化的脂质双分子层的自氧化:铁死亡的实际驱动因素是什么?脂氧合酶(LOX),特别是12/15-LOX(即ALOX15),已被反复认为在脂质过氧化和铁死亡中发挥核心作用,而PEBP1,一种促进15-LOX催化AA-PE的小支架蛋白,被报道调节上皮细胞和神经元铁死亡。p53也通过其转录靶点亚精胺/精胺N1 -乙酰转移酶1间接促进ALOX15的表达来调控铁死亡。然而,LOX在铁死亡启动过程中的主导作用受到了作者和其他研究人员的质疑,研究发现,敲除Alox15未能挽救成纤维细胞、CD8+ T细胞、胚胎性致死以及GPX4缺陷成年小鼠急性肾衰中诱导的铁死亡。此外,对LOX亚型(即5-LOX、p12-LOX和15-LOX-1)的过表达研究表明,无论LOX对PLOOH的初始积累有什么贡献,脂质自氧化是铁死亡的实际驱动因素。
铁积极参与了脂质过氧化的起始,但铁如何机制性地促进这一过程仍然难以评价。考虑到铁与血红素和非血红素结合在许多酶中,如LOX和POR,铁可能不仅通过Fenton化学促进脂类自氧化,而且参与某些酶反应。无论如何,铁螯合至少在细胞环境中是阻止脂质过氧化和相关铁死亡的有效方法。
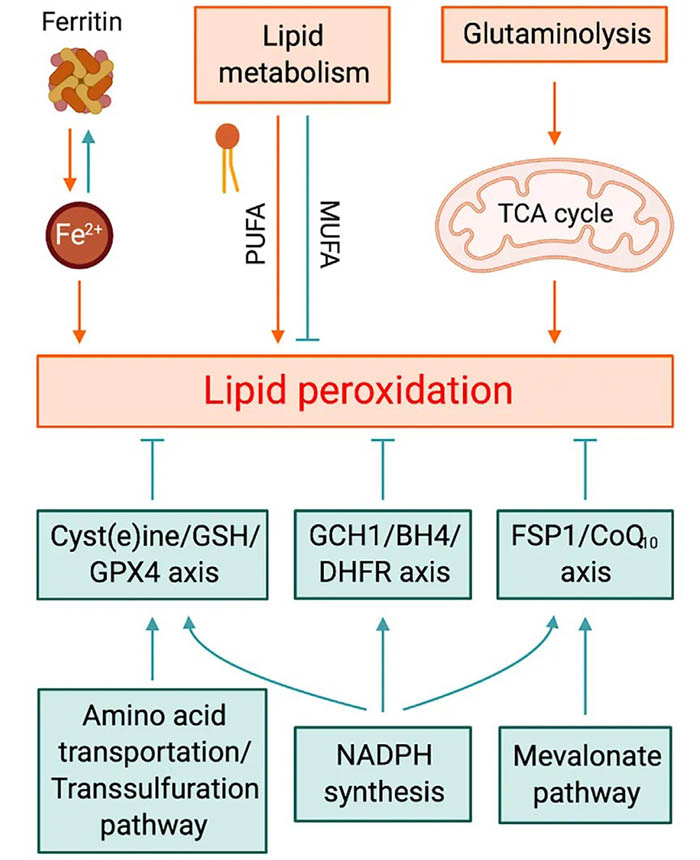
图1:影响细胞对铁死亡易感性的代谢过程
抑制铁死亡的主要系统。
Cyst(e)ine/GSH/GPX4轴
多年来,Cyst(e)ine/GSH/GPX4系统被认为是限制铁死亡的唯一系统。改变GPX4水平和/或活性的条件将对细胞生存产生直接影响;基因敲除和药物抑制GPX4仍然是触发铁死亡的经典方法。由于GPX4是一种硒蛋白,其生物合成依赖于硒半胱氨酸(Sec)的共翻译结合。
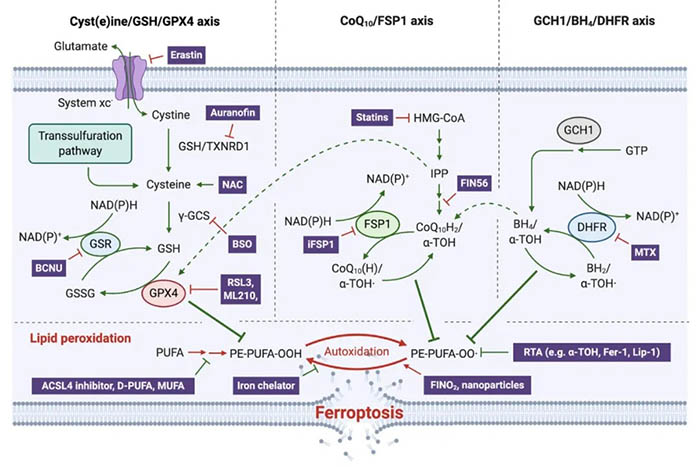
图2:调控铁死亡的三大支柱
NAD(P)H/FSP1/CoQ10系统
虽然FSP1的抗抗铁死亡作用是最近才发现的,但早在2001年,人们就注意到一种未知的具有NADH氧化酶功能的基因与GPX4一起可以防止低细胞密度培养的伯基特淋巴瘤(Burkitt lymphoma, BL)细胞凋亡。这种BL细胞的细胞死亡可以通过促进细胞摄取胱氨酸来显著预防,现在被认为是铁死亡。
GCH1/ BH4/DHFR系统
最近,CRISPR介导的全基因组激活筛选允许鉴定鸟苷三磷酸环水解酶1 (GCH1;四氢生物蝶呤[BH4]合成的限速酶)以独立于GPX4的方式对抗铁死亡。因此,BH4作为一个需要二氢叶酸还原酶(DHFR)再生的有效RTA出现。DHFR阻断与GPX4抑制在基因或药理学上协同诱导铁死亡。
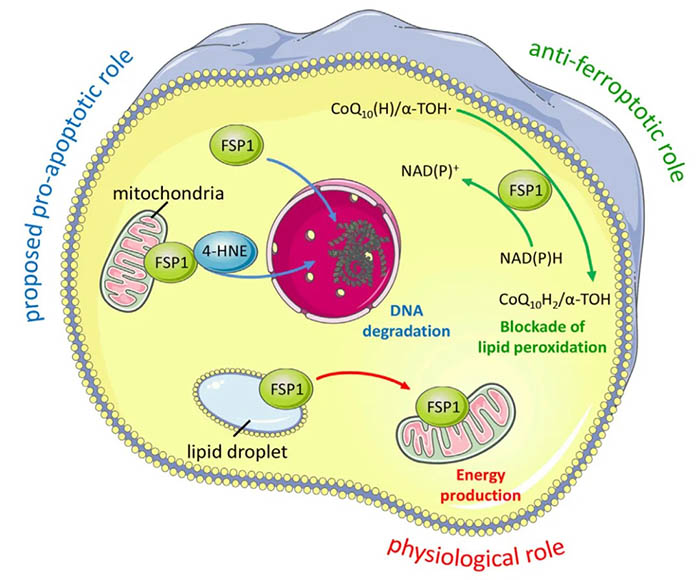
图3:FSP1在细胞死亡和生理背景中的意义
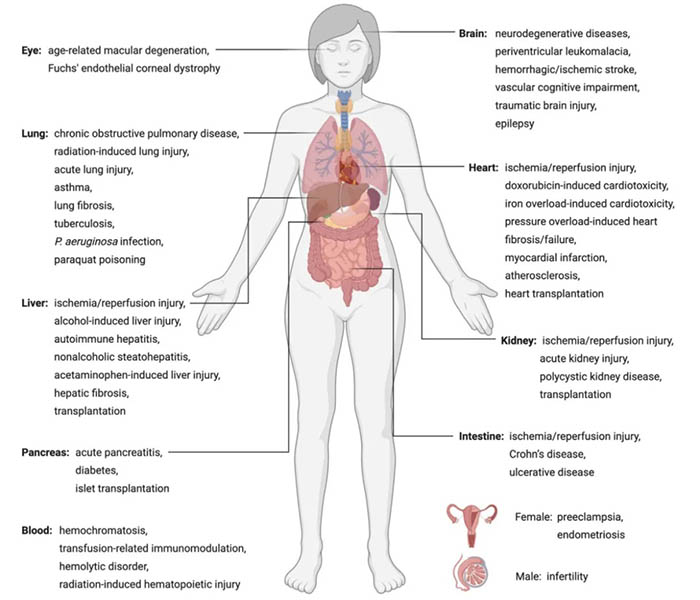
铁死亡及其在人类疾病中的意义。
铁死亡在退行性疾病中的作用
由于缺乏铁死亡特有的稳定的生物标志物,铁死亡与人类疾病之间的联系仍然缺乏探索;因此,作者目前对这一课题的理解主要是基于对GPX4基因敲除小鼠和重现铁死亡特征的病理模型的研究。Gpx4基因的全敲除导致早期胚胎死亡,原因尚不清楚。他莫西芬诱导的神经元或前脑神经元特异性GPX4缺失会导致神经退行性变和行为障碍。在疾病模型中验证铁死亡的特征或铁死亡抑制剂的治疗效果有助于我们理解铁死亡在某些疾病背景下的参与。事实上,脂质过氧化和铁积聚是包括阿尔茨海默氏症、帕金森症、亨廷顿症等在内的许多神经退行性疾病的特征。
铁死亡和癌症抑制
通过研究erastin和RSL3的致死机制,人们最初认为铁死亡需要RAS突变体的表达,尽管后来的研究推翻了这些早期的假设。铁死亡诱导剂已被证明对几种类型的癌症特别有效,包括三阴性乳腺癌,弥漫性大B细胞淋巴瘤、肾透明细胞癌、卵巢透明细胞癌、胰导管腺癌、肝细胞癌、神经母细胞瘤、肾上腺皮质癌等。铁死亡是一些现有化疗药物像altretamine,索拉非尼和柳氮磺胺吡啶细胞毒性的主要死亡机制。
Figure 4
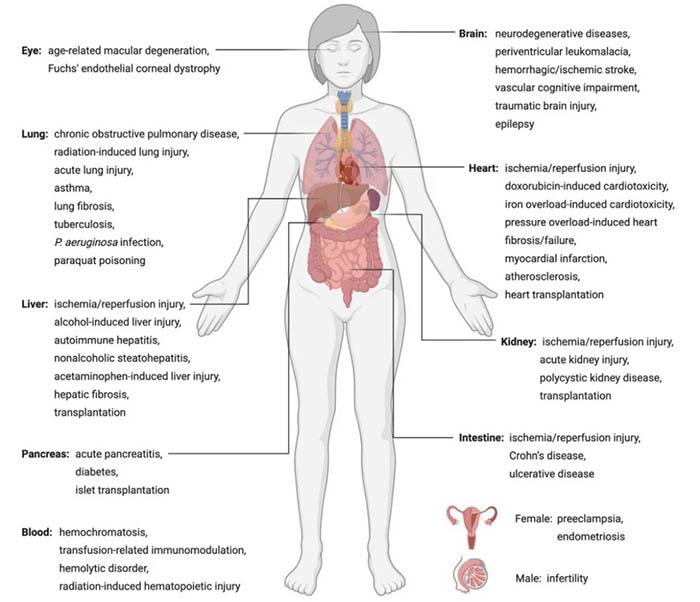
图4:铁死亡对不同疾病的可能影响
结论和展望:
最后,大量关于铁死亡和相关脂质过氧化的研究揭示了令人兴奋的见解:细胞命运决定的分子和代谢基础将被利用,以改变生存和死亡之间的平衡。
原文链接:
https://www.cell.com/cell-metabolism/fulltext/S1550-4131(20)30544-1?_returnURL=https%3A%2F%2Flinkinghub.elsevier.com%2Fretrieve%2Fpii%2FS1550413120305441%3Fshowall%3Dtrue
参考文献:
[1] Zheng J, Conrad M. The Metabolic Underpinnings of Ferroptosis. Cell Metab. 2020 Dec 1;32(6):920-937. doi: 10.1016/j.cmet.2020.10.011. Epub 2020 Nov 19. PMID: 33217331.













